Welche Technologien werden eingesetzt?
Der Humangenetik steht heute ein großes Methodenspektrum zur Verfügung. Mit zunehmendem technischem und wissenschaftlichem Fortschritt wächst auch die Anzahl möglicher diagnostischer Pfade von Jahr zu Jahr. Die modernen Methoden der Next-Generation-Sequenzierung machen es möglich, durch parallele Analysen aller im Zusammenhang mit einer Erkrankungsgruppe bekannter Gene, zeit- und kosteneffizient zur zugrundeliegenden Diagnose zu gelangen. Unsere hauseigenen NovaSeq 6000 können innerhalb kürzester Zeit große Mengen an Probenmaterial sequenzieren. Im Rahmen unserer Diagnostik-Panels haben wir standardisierte Abläufe für viele verschiedene Erkrankungen etabliert und setzten Auswertungsschwerpunkte, die Sie frei wählen können. Gerne können diese Gen-Sets nach Rücksprache ohne zusätzlichen Sequenzieraufwand und Zeitverlust um weitere Gene ergänzt werden.
Wir führen jeden Schritt des Prozesses vom Probeneingang bis zum Befundversand eigenhändig durch. Gerne beantworten wir Ihre Fragen und unterstützen Sie bei der Diagnosestellung Ihrer Patientinnen und Patienten. Wir freuen uns auf eine gute Zusammenarbeit und hoffen, auch Sie, wie viele Ärztinnen und Ärzte vor Ihnen, durch unsere zuverlässige Qualität überzeugen zu können.
NEXT GENERATION SEQUENCING (NGS)
Das Next Generation Sequencing stellt das technologische Kernstück der Diagnostik im Zentrum für Humangenetik Tübingen dar. Kaum eine Technologie hat die genetische Diagnostik in so kurzer Zeit derart eingehend geprägt. Seit über 10 Jahren setzen wir daher NGS für unsere Patientinnen und Patienten ein – und sind damit Pioniere in der Nutzung dieser Technologie in der Diagnostik. Das Zentrum für Humangenetik Tübingen kann aktuell auf bis zu sieben Illumina NovaSeq 6000 Geräten sequenzieren lassen. Mit der CeGaT GmbH haben wir einen starken und verlässlichen Partner an unserer Seite. Dabei vereint die Illumina SBS (sequencing by synthesis) Technologie mit short reads in idealer Weise die Ansprüche an Daten zur diagnostischen Nutzung: Eine hohe Qualität im hohen Durchsatz bei angemessenen Kosten. Die hauseigene Bioinformatik erlaubt uns, das Beste aus den Daten herauszuholen. Egal ob Sequenzierlabor oder Variantencalling und CNV Berechnung – Expertise und Qualität machen den Unterschied.
Somatische Diagnostik bei Tumorerkrankungen
Tumore sind genetische Erkrankungen. Tumorzellen tragen genetische Veränderungen, die ungebremstes Wachstum begünstigen und die in normalen Zellen dieses Gewebetyps nicht vorkommen. Man spricht von somatischen Mutationen (soma = im Körper) im betroffenen Gewebe. Da diese Mutationen nicht nur den Treiber für ungebremstes Wachstum darstellen, sondern oft auch Ansatzpunkte für Therapien repräsentieren, ist der Tumor-Normal Abgleich die effizienteste Methode zur sicheren Detektion von somatischen Mutationen. Hierfür wird eine Probe des Tumors und (meist) eine Blutprobe parallel sequenziert und die Ergebnisse verglichen. Alle genetischen Veränderungen, die nur im Tumor, nicht jedoch im Blut (als normales, gesundes Kotrollgewebe) vorkommen, sind Ziel der somatischen Diagnostik. Manche Tumormutationen tauchen immer wieder auf in denselben Geweben bei unterschiedlichen Patientinnen und Patienten. Diese typischen Treibermutationen sind gut charakterisiert. Eine Analyse, die exakt auf diese Veränderungen abzielt, kann auch ohne Tumor-Normal Abgleich erfolgreich durchgeführt werden.
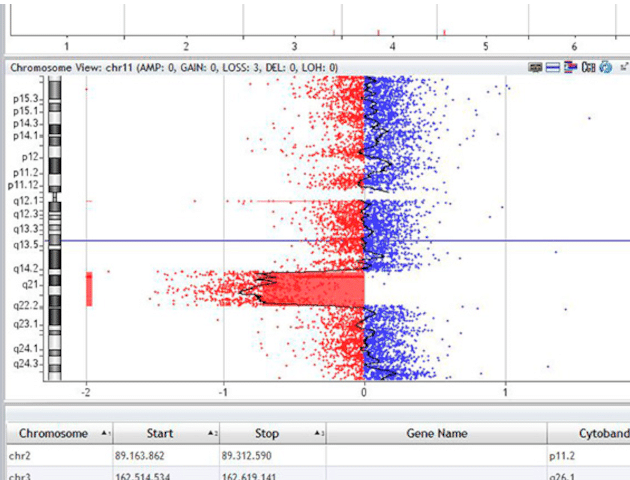
CNV (Kopienzahlveränderungen)
Neben dem Nachweis von ursächlichen Sequenzvarianten ist die Detektion von genomischen Zugewinnen (Duplikationen) und Verlusten (Deletionen) in der Diagnostik unabdingbar. Solche „copy-number-variations (CNVs)“ können einzelne Exons, aber auch größere chromosomale Abschnitte betreffen.
Je nach diagnostischer Anforderung stehen für den Nachweis solcher CNVs am Zentrum für Humangenetik Tübingen verschiedene Untersuchungsmethoden zur Verfügung. Mittels Array-CGH und sWGS kann eine genomweite Detektion größerer CNVs erfolgen (Auflösung >=50kb). Ein gezielter Nachweis relevanter Zugewinne oder Verlust auf Genebene kann mittels MLPA-Verfahren oder der quantitativen PCR (qPCR) erfolgen. Grundsätzlich wird bei der Exomsequenzierung am Zentrum für Humangenetik Tübingen ein NGS-basiertes CNV-calling durchgeführt. Hierbei erfolgt der Nachweis von CNVs durch den Vergleich der Abdeckung (coverage) der diagnostischen Probe mit einem Referenzdatensatz.
All diese Methoden weisen eine unterschiedliche Auflösung, Sensitivität und Spezifität auf. Je nach diagnostischer Fragestellung findet die Methode Anwendung, die am besten geeignet ist, den Fall zu lösen.
Sanger Sequenzierung
Seit fast 50 Jahren im Dienst und noch immer diagnostisch relevant – die Sanger Sequenzierung. Diese Methode wird vor allem angewandt, wenn nur ein kleiner Teil des Erbgutes analysiert werden muss. Daher wird diese Technologie für Segregationsanalysen bekannter familiärer pathogener Varianten herangezogen, oder wenn das klinische Bild einer Patientin oder eines Patienten den Verdacht auf ein einzelnes Gen lenkt. Bei der Kettenabbruchsynthese wird mit fluoreszenzmarkierten DNA-Bausteinen gearbeitet (Dye-Terminator-Basen), die mittels einer PCR viele Fragmente zufälliger Länge aus der Matrize der Patienten-DNA erzeugen. Mittels Kapillargelelektrophorese (ABI 3730) werden diese Fragmente der Länge nach aufgetrennt und die Fluorophore optisch detektiert. Aus diesem Lichtmuster lässt sich die Sequenz der Patienten-DNA zusammensetzen. Dabei werden typischerweise Leseweiten von 600-1500 Basenpaaren erreicht. Ein Abgleich der Sequenz der Patienten-DNA mit einer unveränderten Wildtyp-Sequenz fördert individuelle Unterschiede (Varianten) zutage, die die Ursache für eine Erkrankung darstellen können.
Repeat-Analysen
Repeat-Erkrankung stellen vor allem bei neurodegenerativen und neuromuskulären Erkrankungen eine häufige Krankheitsursache dar. Meist handelt es sich dabei um Expansionen (Verlängerung des Repeats), sich wiederholender Triplets der DNA (z.B. die Basenfolge „CAG“) innerhalb eines krankheitsrelevanten Gens. Seltener sind auch längerer Motive wie Pentamere (5 Basen) oder Dodecamere (12 Basen) in bestimmten Genen krankheitsursächlich expandiert. Diese Veränderungen können zwar methodisch bedingt nicht durch die Hochdurchsatz-Sequenzierung erfasst werden, wir bieten aber eine Untersuchung mittels „Repeat-überspannender PCR“ und/oder mittels „Repeat-Primed PCR“ als Fragmentlängenanalyse an. Wir bieten verschiedene Untersuchungen der gängigen Repeat-Erkrankungen mit unseren hausintern entwickelten und validierten Tests an.
High-Sensitivity Mutationsanalysen
In manchen Fällen ist eine Biopsie (Entnahme von Tumor-Material) nicht ohne weiteres möglich, z. B. weil der Tumor an einer besonders schlecht zugänglichen Stelle liegt oder nicht ohne Gefahr für die Patientin oder den Patienten operiert werden kann. In solchen Fällen kann man versuchen, die Mutationen des Tumors mittels einer Liquid Biopsy (Flüssig-Biopsie) dennoch zu analysieren. Hierbei macht man sich die Tatsache zunutze, dass Tumore oft bedingt durch ihr starkes Wachstum und den Angriff des Immunsystems auf die Tumorzellen eine höhere Rate an Zellverlusten erleiden, als dies für gesundes Gewebe typisch ist. Dabei geben die untergehenden Tumorzellen genetisches Material (DNA) in die Umgebung frei. Durch den Blutstrom wird diese als zellfreie Tumor-DNA bezeichnete Erbinformation des Tumors im Körper verteilt und ist für die genetische Diagnostik nutzbar. Durch spezielle Probenröhrchen, die helfen, diese zellfreie DNA zu stabilisieren, und ein darauf abgestimmtes Isolationsverfahren kann die zellfreie DNA sequenziert werden – ohne den Tumor selber direkt biopsieren zu müssen. Das Probenmaterial ist hierbei eine normale Blutprobe, wie sie für andere Zwecke oft von Ärztinnen und Ärzten entnommen wird. Neben Blut, kann zellfreie Tumor-DNA auch aus anderen Körperflüssigkeiten gewonnen werden, wie z. B. Nervenwasser (Liquor) oder Ascites.
Da die Mengen an zellfreier DNA oftmals sehr viel geringer sind, als die bei klassischen Biopsaten isolierbare Menge, besteht die Möglichkeit, über ein spezielles Sequnzierverfahren Tumor-Mutationen auch in kleinsten Mengen nachzuweisen (0,25 % Frequenz-Anteil). Hierbei wird eine besonders tiefe Abdeckung der Zielbereiche angestrebt und spezielle Adaptermoleküle verhindern eine Anhäufung von technisch bedingten Fehlern in der Probenaufbereitung. Die so durchführbare Sequenzierung ist um den Faktor 20 sensitiver, als eine herkömmliche „Next Generation Sequencing“ Analyse. Sie beschränkt sich aber auf einen kleineren, vordefinierten Bereich mit häufig auftretenden Treibermutationen (Hotspots).
Bleiben Sie informiert
Melden Sie sich jetzt für unseren kostenlosen Newsletter an. Wir informieren Sie rund um die Themen Humangenetik und Pränataldiagnostik.
Schreiben Sie uns
Wir helfen Ihnen gerne weiter.